Il kit per il test SARS-CoV-2 sviluppato dalla nostra azienda è stato ufficialmente certificato dalla FDA EUA il 22 maggiond, annunciato dal sito ufficiale della FDA.Ciò significa che il nostro prodotto ha ricevuto un “pass” nel mercato statunitense e può essere lanciato per test su larga scala nei laboratori di certificazione medica CLIA negli Stati Uniti.

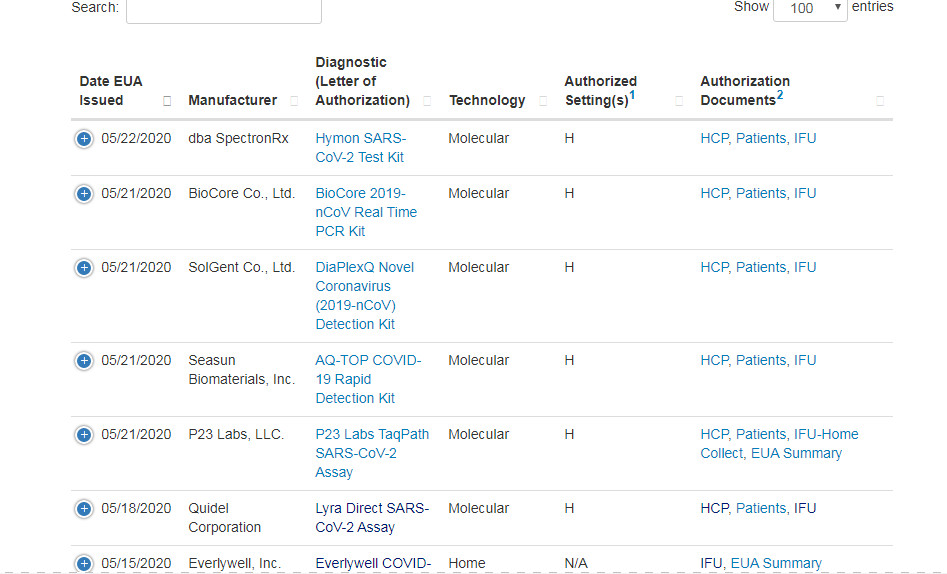
Siamo la prima azienda cinese a ricevere la certificazione FDA EUA il mese scorso, la quinta azienda in Cina ad aver ottenuto la FDA EUA statunitense e l'unica azienda che non ha società affiliate all'estero approvate dalla FDA.
"[Prima dello scoppio del nuovo coronavirus,] la nostra azienda non aveva rapporti commerciali con la SpectronRX Pharmaceutical Company degli Stati Uniti", ha affermato il CEO Dr. Tammy Tan.“È stato [dopo lo scoppio del COVID-19 negli Stati Uniti] che SpectronRX ci ha contattato attivamente dopo aver appreso informazioni rilevanti da Internet e da altri canali, che ci hanno contattato e si sono offerti di collaborare con noi.Dopo alcune trattative, li abbiamo autorizzati a rappresentare il nostro Hymon®SARS-CoV-2 Test Kit, che è stato sviluppato e prodotto da noi, in Nord America”.
John Zehner, CEO di SpectronRX Pharmaceuticals, ha scritto alla nostra azienda: “L’epidemia di COVID-19 continua a mettere alla prova e a sfidare il sistema medico statunitense.Abbiamo bisogno di misure diversificate per combattere il virus.L'Imone®Il kit per il test SARS-CoV-2 ha il vantaggio di essere veloce, semplice e accurato.Può essere utilizzato in più di 7.000 laboratori certificati CLIA negli Stati Uniti per test su larga scala”.
In futuro, uniremo le forze con la SpectronRX Pharmaceutical Company per continuare a fornire a pazienti e medici un valore unico nel campo della diagnosi e del trattamento delle principali malattie.
Orario di pubblicazione: 29 maggio 2020

